انواع جامدات
جامدات را بر مبناي نوع ذرات سازنده، نحوه اتصال ذرات سازنده بهم و خواص مي توان به طور كلي در چهار دسته جامدات مولكولي، جامدات كووالانسي، جامدات يوني و جامدات فلزي طبقه بندي نمود. اين طبقه بندي همچنين مي تواند براي طبقه بندي مواد نيز بكار رود و مختص حالت جامد نباشد. در ادامه به بررسي ويژگيهاي ساختاري و خواص هر دسته از اين جامدات يا مواد مي پردازيم.
جامدات مولكولي
جامدات
مولكولي
متشكل از
مولكولهاي
مجزا از هم
هستند. بعنوان
مثال مي توان
آب، شكر و
الكل اتانول
را در نظر
گرفت كه به
ترتيب متشكل
از مولكولهاي
مجزا از هم ![]() ،
،
![]() و
و
![]() هستند.
در حالت خالص
برهم كنش هاي
بين مولكولها
مي تواند
لاندن، قطبي
يا هيدروژني
يا تركيبي از
اينها باشد.
بعنوان مثال
در ماده
مولكولي يد
هستند.
در حالت خالص
برهم كنش هاي
بين مولكولها
مي تواند
لاندن، قطبي
يا هيدروژني
يا تركيبي از
اينها باشد.
بعنوان مثال
در ماده
مولكولي يد ![]() تنها
بر هم كنش هاي
لاندن داريم،
در ماده مولكولي
گوگرد
تترافلوئوريد
تنها
بر هم كنش هاي
لاندن داريم،
در ماده مولكولي
گوگرد
تترافلوئوريد
![]() هم
برهم كنش هاي
لاندن و هم
برهم كنش هاي
دوقطبي –
دوقطبي داريم
و در ماده
مولكولي آب
هم
برهم كنش هاي
لاندن و هم
برهم كنش هاي
دوقطبي –
دوقطبي داريم
و در ماده
مولكولي آب ![]() هر
سه نوع برهم
كنش لاندن،
قطبي و
هيدروژني مشاهده
مي شود. با
افزايش
اندازه
مولكولها،
نيروهاي
لاندن قويتر
مي شوند و
اندازه نيروهاي
بين مولكولي و
دماي ذوب و
جوش افزايش مي
يابد. قطبيت
بالاي مولكول
و قابليت
تشكيل پيوند
هيدروژني نيز
اثر مشابهي
روي قدرت
نيروهاي بين مولكولي
و دماي ذوب و
جوش ماده
مولكولي دارد.
هر
سه نوع برهم
كنش لاندن،
قطبي و
هيدروژني مشاهده
مي شود. با
افزايش
اندازه
مولكولها،
نيروهاي
لاندن قويتر
مي شوند و
اندازه نيروهاي
بين مولكولي و
دماي ذوب و
جوش افزايش مي
يابد. قطبيت
بالاي مولكول
و قابليت
تشكيل پيوند
هيدروژني نيز
اثر مشابهي
روي قدرت
نيروهاي بين مولكولي
و دماي ذوب و
جوش ماده
مولكولي دارد.
تمرين:
مواد ![]() و
و
![]() (n-
بوتان) هر دو
جزء مواد
مولكولي
هستند. با
وجود اينكه
مولكولهاي آب
اندازه كوچك
تر و در نتيجه
لاندن ضعيف
تري در مقايسه
با مولكولهاي n-
بوتان دارند،
در شرايط
معمولي (دما و
فشار اتاق) آب
به صورت مايع
و نرمال-
بوتان به صورت
گاز است. چگونه
توجيه مي
كنيد؟
(n-
بوتان) هر دو
جزء مواد
مولكولي
هستند. با
وجود اينكه
مولكولهاي آب
اندازه كوچك
تر و در نتيجه
لاندن ضعيف
تري در مقايسه
با مولكولهاي n-
بوتان دارند،
در شرايط
معمولي (دما و
فشار اتاق) آب
به صورت مايع
و نرمال-
بوتان به صورت
گاز است. چگونه
توجيه مي
كنيد؟
*****
متقارن تر شدن مولكولها باعث جفت و جور شدن راحت تر مولكولها با همديگر در حالت جامد و در نتيجه نزديك تر شدن مولكولها به همديگر و افزايش نيروهاي بين مولكولي مي شود. به همين علت وجود تقارن باعث افزايش دماي ذوب مي شود. در دماهاي بالاتر به علت افزايش جنب و جوش هاي نامنظم مولكولي و دورتر شدن مولكولها از همديگر قابليت نزديك تر شدن مولكولها به همديگر به علت وجود تقارن اهميت خود را از دست مي دهد و به همين جهت تقارن بر دماي جوش تأثيرگذار نيست.
تمرين: دو تركيب B , A زير را در نظر بگيريد:

دماهاي ذوب B , A به ترتيب برابر 13.25 °C و -47.8 °C است. دماهاي جوش B , A به ترتيب برابر 138.4 °C و 139.1 °C است.
الف) چرا B , A با وجود اينكه ايزومر و هم اندازه اند، اختلاف دماي ذوب بالايي (برابر با حدودا 60 °C ) دارند؟
ب) چرا دماهاي جوش B , A برخلاف دماهاي ذوب آنها به همديگر نزديك است؟
*****
در مورد
مواد مولكولي
بايستي بخاطر
داشت كه
نيروهاي بين
مولكولی و نه
نيروهاي درون
مولكولي در
تعيين دماي
ذوب و جوش مهم
هستند. اين
مطلب از آنجا
ناشي مي شود كه
دور شدن
مولكولها از
همديگر
معمولاً نيروهاي
درون مولكولي
را تحت تأثير
قرار نمي دهد
و نيروهاي
درون مولكولي
مقاومتي در
برابر دور شدن
مولكولها از
هم نشان نمي
دهند. بعنوان
مثال مي توان
ماده مولكولي ![]() را
در نظر گرفت
كه بعلت
نيروهاي ضعيف
لاندن بين
مولكولهاي
كوچك هيدروژن
دماي جوش فوق
العاده
پائيني (20 K) دارد و
پيوندهاي
كووالانسي
قوي H- Hكه
بصورت
نيروهاي درون
مولكولي
هستند، تأثيري
بر اين امر
ندارند.
بعنوان مثالي
ديگر مي توان
دو تركيب B , A زير را كه
ايزومر
ساختاري
همديگرند، مي
توان در نظر
گرفت:
را
در نظر گرفت
كه بعلت
نيروهاي ضعيف
لاندن بين
مولكولهاي
كوچك هيدروژن
دماي جوش فوق
العاده
پائيني (20 K) دارد و
پيوندهاي
كووالانسي
قوي H- Hكه
بصورت
نيروهاي درون
مولكولي
هستند، تأثيري
بر اين امر
ندارند.
بعنوان مثالي
ديگر مي توان
دو تركيب B , A زير را كه
ايزومر
ساختاري
همديگرند، مي
توان در نظر
گرفت:

انتظار داریم تركيب A بعلت هم جهت تر بودن گروههاي كشنده الكترون قطبي تر از تركيب B باشد و در نتیجه نیروهای قطبی- قطبی قویتری داشته باشد، اما دماي ذوب A برابر -7 °C و كمتر از دماي ذوب تركيب B برابر با 108 °C است. اين مطلب از آنجا ناشي مي شود كه در تركيب A گروههاي –CHO, -OH در مجاورت همديگر قرار دارند و مي توانند با هم پيوند هيدروژني بصورت درون مولكولي تشكيل دهند، که این مطلب در شکل زیر نمایش داده شده است:

اما در تركيب B بعلت دوري گروههاي –CHO , -OH يك مولكول از همديگر، گروه –OH يك مولكول با گروه –CHO مولكول ديگر پيوند هيدروژني بصورت بين مولكولي تشكيل مي دهد. بنابراين در تركيب B حضور پيوندهاي هيدروژني (بصورت بين مولكولي) باعث تقويت نيروهاي بين مولكولي و افزايش دماي ذوب مي شود، درحاليكه اتفاق مشابه در تركيب A رخ نمي دهد.
تمرين: انتظار داريد كداميك از دو تركيب B , A زير دماي ذوب بالاتري داشته باشد؟ چرا؟

*****
مواد
مولكولي در
مقايسه با
ديگر مواد
(يوني، كووالانسي
و فلزي)
معمولاً دماي
ذوب و جوش
بسيار پايين تري
دارند. مثلاً
ماده مولكولي
آب در ![]() ذوب
مي شود، در
حاليكه ماده
يوني سديم
كلريد در
ذوب
مي شود، در
حاليكه ماده
يوني سديم
كلريد در ![]() ذوب
مي شود.
افزايش دماي
ذوب و جوش
مواد مولكولي
با افزايش
اندازه
مولكولها
توسط دمايي كه
پيوندهاي
كووالانسي
درون
مولكولها
شروع به شكسته
شدن مي كنند،
محدود مي شود.
بعنوان مثال
مي توان در
شيمي آلي مواد
مولكولي با هر
اندازه
دلخواهي براي
مولكولها
سنتز يا تهيه
نمود، اما
پيوندهاي
كووالانسي
ساده كربن- كربن
اين مواد در
دماهاي
ذوب
مي شود.
افزايش دماي
ذوب و جوش
مواد مولكولي
با افزايش
اندازه
مولكولها
توسط دمايي كه
پيوندهاي
كووالانسي
درون
مولكولها
شروع به شكسته
شدن مي كنند،
محدود مي شود.
بعنوان مثال
مي توان در
شيمي آلي مواد
مولكولي با هر
اندازه
دلخواهي براي
مولكولها
سنتز يا تهيه
نمود، اما
پيوندهاي
كووالانسي
ساده كربن- كربن
اين مواد در
دماهاي ![]() شروع
به شكسته شدن
مي كنند و
بنابراين اين
مواد در چنين
دماهايي
تجزيه مي شوند
و نمي توان براي
آنها دماهاي
ذوب يا جوش
بالايي
مشاهده كرد.
شروع
به شكسته شدن
مي كنند و
بنابراين اين
مواد در چنين
دماهايي
تجزيه مي شوند
و نمي توان براي
آنها دماهاي
ذوب يا جوش
بالايي
مشاهده كرد.
مواد مولكولي را معمولاً مي توان براحتي در حلالهاي مناسب حل نمود. مثلاً اتانول بخوبي در حلال آب و يد بخوبي در حلال تتراكلريد كربن حل مي شود. مواد مولكولي قطبي در حلال هاي قطبي و مواد مولكولي غيرقطبي در حلال هاي غيرقطبي بخوبي حل مي شود كه اين مطلب بصورت «قاعده همجنس در همجنس حل مي شود» نيز بيان مي گردد.
تمرين:
انتظار داريد HF
در آب بهتر حل
شود يا در
هگزان ![]() ؟
چرا؟
؟
چرا؟
*****
مواد مولكولي چه در حالت جامد و چه در حالت مايع معمولاً رسانايي الكتريكي بسيار ضعيفي دارند و نارساناي جريان الكتريكي محسوب مي شوند. همچنين اين مواد معمولاً رساناهاي خوبي براي گرما نيستند. بعنوان مثال مي توان مقداري يخ در يك لوله آزمايش ريخت و تكه اي توري سيمي روي آنها انداخت و سپس به لوله آزمايش آب اضافه نمود و تنها قسمت بالاي لوله آزمايش و آب مجاور آن را حرارت داد. خواهيم ديد كه آب بالاي لوله بجوش مي آيد درحاليكه يخ واقع در پايين لوله همچنان ذوب نشده است. اين مشاهده براساس رسانايي گرمايي ضعيف آب كه يك ماده مولكولي است، مي تواند توجيه شود. جامدات مولكولي بعلت برهم كنش هاي ضعيف تر بين ذرات سازنده در مقايسه با ديگر جامدات تحت اثر ضربه راحت تر از هم مي پاشند و خرد مي شوند.
جامدات كووالانسي
جامدات
كووالانسي
شبكهاي از
اتمهاي متصل
بهم با
پيوندهاي
كووالانسي
هستند. تفاوت
جامدات
كووالانسي با
جامدات مولكولي
اينست كه
جامدات
مولكولي
متشكل از
مولكولهاي
مجزا از همند
كه معمولاً هر
مولكول از تعداد
محدود و كمي
اتم تشكيل شده
است، در
حاليكه در
جامدات
كووالانسي
معمولاً كليه
اتمهاي ماده
(بعنوان مثال
در حد عدد
آووگادرو تا
اتم) بصورت
پيوسته با
پيوندهاي
كووالانسي به
همديگر
متصلند و در
واقع كل يك
تكه جامد
كووالانسي
بصورت يك
مولكول غول
پيكر است كه
تمام اتمها را
شامل مي شود.
از اين رو
مواد پليمري
را مي توان حد
واسط مواد
مولكولي و
مواد
كووالانسي در نظر
گرفت كه با
افزايش مقدار
پليمري شدن و
اندازه
مولكولهاي
پليمر، ماده
پليمر به
تدريج از يك
ماده مولكولي
به يك ماده
كووالانسي
تغيير ماهيت
مي دهد. از
جامدات
كووالانسي مي
توان به
الماس، گرافيت،
كوارتز ![]() ،
سيليسيم،
ژرمانيم،
بورنيتريد (BN)،
كربوراندوم
يا سيليسيم
كربيد (SiC)
و ... اشاره كرد
كه ساختار
برخي از آنها
را در ادامه
بررسي مي
كنيم.
،
سيليسيم،
ژرمانيم،
بورنيتريد (BN)،
كربوراندوم
يا سيليسيم
كربيد (SiC)
و ... اشاره كرد
كه ساختار
برخي از آنها
را در ادامه
بررسي مي
كنيم.
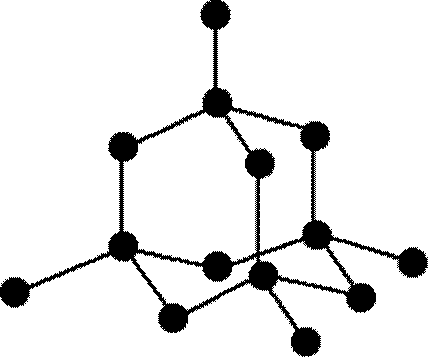
الماس يك جامد كووالانسي و يكي از آلوتروپ هاي عنصر كربن است كه در آن هر اتم كربن با چهار پيوند ساده يا يگانه به چهار اتم كربن ديگر متصل است و قطعه اي از آن را مي توان به صورت زير نمايش داد:
گرافيت يكي ديگر از آلوتروپ هاي عنصر كربن است كه بصورت يك جامد كووالانسي در نظر گرفته مي شود. گرافيت ساختار لايه لايه دارد كه هر لايه شبيه كندوي زنبورعسل متشكل از شش ضلعي هايي است كه اتمهاي كربن در رأس هاي شش ضلعي ها واقع شده اند. براي هر اتم كربن در اين شش ضلعي ها مي توان دو پيوند يگانه و يك دوگانه يا سه پيوند سيگما و يك پيوند پاي در نظر گرفت. قطعه اي از ساختار لايه لايه و ساختار هر لايه را مي توان به صورت زير نمايش داد:
|
|
|
براي
تشكيل
پيوندهاي
پاي، هر اتم
كربن يك اوربيتال
p
عمود بر لايه
يا همان صفحه
شش ضلعي ها مي آورد
كه كليه اين
اوربيتالهاي p
بصورت جانبي
با هم
همپوشاني مي
كنند و الكترونهاي
پاي را در خود
جاي مي دهند و
يك سيستم پيوندي
پاي گسترده بر
روي كل لايه
را بوجود مي
آورند.
بنابراين
نمايش قبلي
براي قطعهاي
از يك لايه
بيانگر يك شكل
رزونانسي
امكان پذير
است و
الكترونهاي
پيوندي پاي
نمايش داده شده
آزادي حركت
دارند و براي
هر سه پيوند
يك اتم كربن
با اتمهاي
كربن مجاورش
مي توان مرتبه
پيوند يكسان
برابر ![]() درنظر
گرفت.
درنظر
گرفت.
سيستم
پيوندي ![]() گسترده
گرافيت اين
امكان را براي
الكترونها فراهم
مي سازد كه در
فضاي
همپوشاني
جانبي اوربيتالهاي
p
حركت كنند و
از يك سمت
لايه به سمت
ديگر آن جابجا
شوند. در
نتيجه گرافيت
در جهت لايه
ها مكانيزمي
براي انتقال
بار يا جريان
الكتريكي دارد
و رساناي برق
است. در جهت
عمود بر لايه
ها چنين
امكاني وجود ندارد
و گرافيت
نارساناي برق
محسوب مي شود.
گسترده
گرافيت اين
امكان را براي
الكترونها فراهم
مي سازد كه در
فضاي
همپوشاني
جانبي اوربيتالهاي
p
حركت كنند و
از يك سمت
لايه به سمت
ديگر آن جابجا
شوند. در
نتيجه گرافيت
در جهت لايه
ها مكانيزمي
براي انتقال
بار يا جريان
الكتريكي دارد
و رساناي برق
است. در جهت
عمود بر لايه
ها چنين
امكاني وجود ندارد
و گرافيت
نارساناي برق
محسوب مي شود.
فاصله بين لايه ها در گرافيت برابر 335pm و طول پيوندهاي ساده كربن- كربن برابر 154 pm است (طول پيوندهاي كربن- كربن در گرافیت بعلت خصلت دوگانه آنها برابر 142pm است). بنابراين لايه هاي گرافيت دورتر از آنند كه بتوانند با هم پيوند كووالانسي تشكيل بدهند. از اين بابت بين لايه ها تنها پيوندهاي لاندن درنظر گرفته مي شود. جابجايي يك لايه نسبت به لايه هاي ديگر در راستاي موازي لايه ها نيازمند غلبه بر نيروهاي قوي اي نيست و از اين رو در گرافيت لايه ها براحتي نسبت به هم مي توانند بلغزند و گرافيت در جهت لايه ها مقاوم نيست. درحاليكه در جهت عمود بر لايه ها اينگونه نيست و گرافيت در جهت عمود بر لايه ها مقاوم است.
آلوتروپی یا آلوتروپیسم از ویژگیهای برخی از عناصر است که در دو یا چند فرم که آلوتروپهای عنصر نامیده می شوند، وجود دارند. نحوه پیوند دادن اتمهای یک عنصر در آلوتروپهای مختلف آن متفاوت است. بعنوان مثال گرافیت و الماس از آلوتروپهای عنصر کربن هستند. آلوتروپی به فرمهای مختلف امکان پذیر برای یک عنصر در یک فاز و نه در فازهای مختلف اشاره دارد. همچنین آلوتروپی برای عناصر و نه مواد مرکب بکار می رود. واژه عمومی تر پلی مورفیسم است که بیانگر اینست که یک ماده جامد ساختارهای کریستالی متفاوتی می تواند داشته باشد.
از آنجائيكه پيوندهاي كووالانسي قوي هستند، دماي ذوب و جوش جامدات كووالانسي بالا است. جامدات كووالانسي معمولاً دماي ذوب و جوش بسيار نزديك بهمي دارند يا بدون مذاب شدن مستقيماً تصعيد مي شوند.
جامدات كووالانسي معمولاً در حلال ها حل نمي شوند، چرا كه برهم كنش هاي حل شونده- حلال معمولاً نمي توانند انرژي مورد نياز براي شكسته شدن پيوندهاي كووالانسي قوي در جامد كووالانسي را تأمين نمايند.
معمولاً جامدات كووالانسي برخلاف گرافيت مكانيزمي براي انتقال جريان الكتريكي ندارند و نارساناي برق هستند. بعلت اتصال اتمها با پيوندهاي كووالانسي قوي حساس به فاصله و جهت جنب و جوش هاي گرمايي يك اتم براحتي و به سرعت به اتمهاي ديگر منتقل مي شود. از اين رو گرما براحتي از يك سر جامد به سر ديگر آن منتقل مي شود و جامدات كووالانسي معمولا رساناي خوب گرما هستند. در اين راستا مي توان جامدات كووالانسي را شبيه مجموعه اي از كره هاي متصل بهم با فنرهاي قوي در نظر گرفت كه ارتعاش يك كره توسط فنرها به سرعت به كره هاي ديگر منتقل مي شود.
جامدات كووالانسي معمولاً سخت، ترد و شكننده اند. اين جامدات معمولاً تحمل ضربه بالايي دارند، اما انعطاف پذير نيستند و در صورت اعمال يك ضربه سنگين تر از حد تحمل آنها معمولاً تغيير شكل نمي دهند و از هم پاشيده شده و خرد مي شوند.
جامدات فلزي
اتمهاي فلزات كه در مقايسه با اتمهاي شبه فلزات و نافلزات راحت تر الكترون از دست مي دهند، دسته اي از مواد به نام مواد فلزي را بوجود مي آورند كه مشخصه بازر آنها پيوند فلزي است. براي توجيه پيوند فلزي می توان از نظريه درياي الكترون آزاد استفاده نمود. نظريه درياي الكترون آزاد ساده و تقريبي بوده، با اين وجود بسياري از خصوصيات كلي فلزات را توجيه مي كند.
در نظريه درياي الكترون آزاد فرض مي شود كه اتمهاي فلزي الكترونهاي والانس خود را از دست مي دهند و به صورت يونهاي مثبت در مي آيند. سپس اين يونهاي مثبت در دريايي از الكترونهاي آزاد بوجود آمده غوطه ور مي شوند و جاذبه يونهاي مثبت و الكترونهاي آزاد منفي اساس كنار هم قرار گرفتن اتمهاي فلزات و تشكيل پيوندي به نام پيوند فلزي است. بعنوان مثال شكل بعدي را كه تشكيل پيوند فلزي در فلز سديم را برمبناي نظريه درياي الكترون آزاد نمايش مي دهد، در نظر بگيريد:

پيوند فلزي پيوند قوي است و بنابراين دماي ذوب و جوش مواد فلزي معمولاً بالاست. برخلاف جامدات كووالانسي اختلاف دماي ذوب و جوش جامدات فلزي معمولاً زياد است.
الكترون هاي آزاد مواد فلزي تحت تأثير ميدانهاي الكتريكي خارجي به راحتي مي توانند جابجا شوند و به همين جهت فلزات هم در حالت جامد و هم در حالت مايع رساناي خوب جريان الكتريكي هستند. جنب و جوش هاي نامنظم گرمايي بعلت دافعه يونهاي مثبت باهم، پيوند فلزي قوي و وجود الكترونهاي آزاد براحتي از يك سرفلز به سر ديگر آن منتقل مي شود. بهمين جهت فلزات رساناي خوب گرما نيز هستند.
فلزات انعطاف پذير هستند و در اثر ضربه معمولاً خرد نمي شوند بلكه تغيير شكل مي دهند و از اين رو خاصيت چكش خواري و ورق كاري دارند.
فلزات معمولاً در حلال هاي معمولي حل نمي شوند. البته گاهي اوقات فلزات بخاطر واكنش شيميايي با حلال در حلال حل مي شوند كه بحث جداگانه خود را دارد. مثلاً فلز سديم با آب واكنش مي دهد و محلول سديم هيدروكسيد و گاز هيدروژن توليد مي نمايد. فلزات مي توانند با هم محلول جامد در جامد تشكيل بدهند كه آلياژ ناميده مي شود. آلياژها از نظر برخي ويژگي هاي فيزيكي يا شيميايي مي توانند با فلزات خالص سازنده تفاوت هاي قابل توجهي داشته باشند و بسياري از معايب فلزات خالص براي كاربرد در صنايع و زندگي روزمره را از بين ببرند. از اين رو است كه آلياژها كاربردهاي وسيعي در دنياي امروزه ما دارند.
جامدات يوني
همانطور كه از نامشان نيز پيداست، جامدات يوني از يونها تشكيل شده اند و داراي پيوند يوني هستند. قبلاً بصورت مقدماتي با پيوند يوني آشنا شديم. در اين بخش خواص بيشتري را در مورد مواد داراي پيوند يوني ياد مي گيريم.
از آنجائيكه پيوند يوني جزء قويترين پيوندهاست و به حالت مذاب يا بخار در آوردن جامدات يوني نيازمند غلبه بر اين پيوند است، جامدات يوني معمولاً دماي ذوب و جوش بالايي دارند. اختلاف دماي ذوب و جوش جامدات يوني مشابه جامدات فلزي معمولاً بالاست.
در حالت جامد يونها آزادي حركت انتقالي ندارند (ذرات تشكيل دهنده ساختار يك جامد معمولاً فقط آزادي حركت ارتعاشي دارند) و بهمين علت مواد يوني در حالت جامد نارساناي جريان الكتريكي هستند. برخلاف حالت جامد، در حالت مذاب مواد يوني يونها مي توانند آزادانه از يك مكان به مكان ديگر جابجا شوند، بهمين علت مذاب مواد يوني رساناي جريان الكتريكي است. با توجه به قوي بودن پيوند يوني و قرارگيري يونها در فواصل نزديك نسبت به همديگر، ارتعاشات گرمايي يونها از يك سر جامد براحتي به سر ديگر آن منتقل مي شود و بر همين اساس، جامدات يوني رساناي خوب گرما هستند.
جامدات يوني معمولاً شكننده هستند و مشابه فلزات انعطاف پذير نيستند. در اثر ضربه و جابجايي لايه هاي يونها نسبت به همديگر، يونها با بار همنام در مجاورت همديگر قرار مي گيرند و دافعه هاي آنها باعث از هم پاشيده شدن و قطعه قطعه شدن جامد يوني مي شود، شكل بعدي اين مطلب را نشان مي دهد.

جامدات يوني ممكن است در حلال هاي قطبي با قطبيت بالا مثل آب حل شوند. در موقع حل شدن آنها انرژي لازم براي شكستن پيوندهاي يوني قوي با انرژي آزاد شده به خاطر تشكيل چندين پيوند يون- دوقطبي ضعيف تر براي هر يون جبران مي شود. در مورد محلول يا نامحلول بودن مواد يوني در حلال آب مي توان از جدول در ادامه آمده كمك گرفت. دقت داشته باشيد كه اين جدول براي موارد متعارف و معمولي است.
|
يون |
انحلال پذيري |
استثناها |
|
|
محلول |
- |
|
|
محلول |
- |
|
|
محلول |
|
|
|
محلول |
|
|
|
نامحلول |
|
|
|
نامحلول |
|
براي
جامدات يوني،
انرژي شبكه
بلور يوني به
صورت مقدار
انرژي لازم
براي تبديل
جامد يوني به
يونهاي گازي
شكل جدا از هم
تعريف مي شود
و با ![]() يا
بصورت خلاصه
تري با
يا
بصورت خلاصه
تري با ![]() نمايش
داده مي شود.
بعبارتي
انرژي شبكه
جامد يوني
نمايش
داده مي شود.
بعبارتي
انرژي شبكه
جامد يوني ![]() كه
از يونهاي
كه
از يونهاي ![]() و
و
![]() تشكيل
شده است،
انرژي مورد
نياز براي
انجام واكنش
زير است:
تشكيل
شده است،
انرژي مورد
نياز براي
انجام واكنش
زير است:
![]()
به عنوان
مثال انرژي
شبكه بلور
يوني ![]() انرژي
مورد نياز
براي انجام
واكنش زير
است:
انرژي
مورد نياز
براي انجام
واكنش زير
است:
![]()
تغيير
آنتالپي
تشكيل شبكه
بلور كه با ![]() نمايش
داده مي شود (
نمايش
داده مي شود ( ![]() حرف اول
كلمه
حرف اول
كلمه ![]() به
معناي شبكه
بلوري است)،
تغيير
آنتالپي واكنشي
است كه در آن
يونهاي
سازنده بلور
در حالت گازي
با هم تركيب
شده و شبكه
بلور جامد را
بوجود مي
آورند.
بنابراين
واضح است كه
بايستي
به
معناي شبكه
بلوري است)،
تغيير
آنتالپي واكنشي
است كه در آن
يونهاي
سازنده بلور
در حالت گازي
با هم تركيب
شده و شبكه
بلور جامد را
بوجود مي
آورند.
بنابراين
واضح است كه
بايستي ![]() باشد.
باشد.
به طوركلي انرژي شبكه بلورهاي يوني رابطه مستقيم با حاصلضرب بار يونها و رابطه معكوس با مجموع شعاعهاي يوني دارد و همچنين تحت تأثير نوع شبكه بلور (نحوه چيدمان يونها در كنار همديگر) و به مقدار كمتر جنس يونها قرار دارد.
بالاتر بودن انرژي شبكه معمولاً به معناي قويتر بودن پيوند يوني و درنتيجه دمايي ذوب و جوش بيشتر و استحكام بالاتر جامد يوني است. البته براي مقايسه پايداري ترموديناميكي جامدات يوني تغيير آنتالپي تشكيل معيار بهتر و دقيق تري از انرژي شبكه است.
مثال: جامدات يوني زير را در نظر بگيريد:
![]()
الف) آنها را به ترتيب انرژي شبكه مرتب كنيد و براي ترتيب خود دليل بياوريد.
ب) برمبناي انرژي شبكه، آنها را به ترتيب دماي جوششان مرتب كنيد.
حل:
الف) در
چهار جامد
يوني ياد شده
بار كاتيون و
آنيون و شعاع
كاتيون يكسان
است، اما از ![]() به
به ![]() شعاع
آنيون افزايش
مي يابد. از
آنجائيكه
بطور كلي
انرژي شبكه با
حاصلضرب
باريونها
رابطه مستقيم
و با مجموع
شعاعهاي يوني
رابطه معكوس دارد
انتظار داريم
انرژي شبكه با
افزايش شعاع
آنيون كاهش
بيابد و ترتيب
انرژي شبكه
جامدات يوني
ياد شده بصورت
زير باشد:
شعاع
آنيون افزايش
مي يابد. از
آنجائيكه
بطور كلي
انرژي شبكه با
حاصلضرب
باريونها
رابطه مستقيم
و با مجموع
شعاعهاي يوني
رابطه معكوس دارد
انتظار داريم
انرژي شبكه با
افزايش شعاع
آنيون كاهش
بيابد و ترتيب
انرژي شبكه
جامدات يوني
ياد شده بصورت
زير باشد:
![]()
ب) انتظار داريم جامد يوني كه انرژي شبكه بالاتري دارد، دماي جوش بيشتري داشته باشد، بنابراين ترتيب دماهاي جوش بايستي همان ترتيب انرژي شبكه ها باشد و داشته باشيم:
![]()
در
نامساوي هاي بالا،
![]() به
معناي
به
معناي ![]() يا
دماي جوشش
است.
يا
دماي جوشش
است.
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||

