جدول تناوبی
تمامی عناصر با اعداد اتمی Z=1 تا Z=118 تاکنون کشف شده اند یا در آزمایشگاههای هسته ای بصورت مصنوعی ساخته شده اند. البته تهیه عناصر با اعداد اتمی 117,115,113 و 118 بصورت قطعی تائید نشده است. 98 عنصر اول ( اعداد اتمی از 1 تا 98) بصورت طبیعی وجود دارند، گرچه مقادیر برخی از آنها در طبیعت فوق العاده ناچیز است و بعضی از آنها قبل از کشف در طبیعت بصورت مصنوعی در آزمایشگاهها ساخته شده بودند. عناصر با اعداد اتمی Z=99 تا Z=118 تنها بصورت مصنوعی در آزمایشگاههای هسته ای تهیه شده اند. با در نظرگفتن ایزوتوپ ها در حدود 340 نوع هسته یا اتم بصورت طبیعی در زمین وجود دارند که می توان آنها را به دو دسته کهن یا پرایموردیل (Primordial Nuclides) و غیرکهن یا غیرپرایموردیل (Non-Primordial Nuclides) طبقه بندی نمود. پرایموردیل ها آنهایی هستند که به همان شکل کنونی قبل از پیدایش زمین وجود داشتند و بر اثر انفجار بزرگ (The Big Bang)، تابش های کیهانی و انفجارهای سوپرنوا قبل از پیدایش منظومه شمسی بوجود آمده اند. 288 پرایموردیل می توان درنظر گرفت که 254 تای آنها پایدار هستند و 34 تای آنها باوجود رادیواکتیویته بودن بعلت نیمه عمر فوق العاده زیاد از پیدایش زمین تاکنون دوام آورده اند. غیرپرایموردیل ها که در حدود 51 تا هستند، آنهایی هستند که حضور آنها در زمین بعلت تولید پیوسته آنها بر اثر تابش کیهانی ( مثل 14C و 3H)، تجزیه مواد رادیواکتیو ( مثل رادون، پولونیم و رادیم در سنگ های محتوی اورانیوم بر اثر واپاشی اورانیوم ) و ... است. علاوه بر هسته های حاضر در زمین، در حدود 3000 هسته نیز بصورت مصنوعی تهیه شده اند که 556 تای آنها نیمه عمری بیش از یکساعت دارند.
جدول تناوبی یک طبقه بندی جدولی از عناصر شیمیائی بر اساس عدد اتمی (تعداد پروتونهای هسته)، آرایش الکترونی و خواص شیمیائی مشابه است. قبل از آنکه با جدول تناوبی ای که امروزه بطور گسترده بکار گرفته می شود، بیشتر آشنا شویم، اشاره ای به تاریخچه پیدایش این جدول می کنیم. تمایل به در نظرگرفتن عناصر بعنوان اجزا سازنده تمام موجودات و اشیا و دسته بندی و نامگذاری آنها از زمانهای خیلی قدیم وجود داشته است. در یونان باستان پنج عنصر زمین، آب، هوا، آتش و اتر (Aether) در نظر می گرفتند که کمابیش بطور مشابه در دیگر تمدن ها نیز بکار می رفت و تا قرون وسطی و رونسانس فرهنگ و اندیشه در اروپا را تحت تاثیر خود قرار داده بود.
در سال 1789 آنتوان لاوازیه (Antoine Lavoisier) لیستی از 33 عنصر شیمیایی را که به گروههای گازها، فلزات، نافلزات و زمینی ها طبقه بندی شده بودند، منتشر کرد. در سال 1829، ولفگانگ دوبرینر (Johan Wolfgang Dobereiner) مشاهده نمود که برخی از عناصر مثل لیتیم، سدیم و پتاسیم خواص مشابهی مانند نرم بودن و واکش پذیر بودن دارند و هنگامیکه بر اساس جرم اتمی مرتب می شوند، جرم اتمی وسطی بطور تقریبی میانگین جرم اتمی اولی و سومی است و بر این اساس قانون سه تایی ها (Law of Triads) را ارائه نمود. بر این اساس دانشمند آلمانی ژملین (Leopold Gmelin) در سال 1843، 10 سه تایی بصورت سه گروه چهار عضوی و یک گروه پنج عضوی ارائه نمود. در سال 1857، دوماس (Jean Baptiste Dumas) روابط بین گروههای مختلف فلزات را توصیف کرد. با وجوداینکه شیمیدانهای زیادی روابط گوناگونی بین دسته های کوچکی از عناصر تشخیص داده بودند، همچنان یک طرح کلی برای در برگرفتن تمام عناصر وجود نداشت.
در سال 1858، اگوست ککوله (August Kekule) مشاهده نمود که کربن در ترکیبات خود مثل متان (CH4) معمولا به چهار اتم دیگر پیوند می خورد و بر اساس آن بتدریج مفهوم ظرفیت که عناصر مختلف با تعداد اتمهای مختلفی ترکیب می شوند، شکل گرفت و در بررسی شباهت خواص شیمیایی و گروه بندی عناصر بعنوان یک فاکتور مهم درنظر گرفته شد. در سال 1862، زمینشناسی به نام چانکورتویس (Alexandre-Emile Beguyer de Chancourtois) نشان داد که هنگامیکه عناصر در یک مارپیچ بر روی یک استوانه بر اساس افزایش جرمهای اتمیشان مرتب می شوند، عناصر با خواص شیمیایی مشابه در فاصله های منظمی تکرار می شوند. او از اصطلاحات زمینشناسی بجای اصطلاحات شیمی استفاده کرده بود و کارش فاقد شکل یا نمودار بود، از این رو توجه کمی به کار او شد. در سال 1864، ژولیوس میر (Julius Lothar Meyer) جدولی از 44 عنصر که براساس ظرفیتشان مرتب شده بود، ارائه داد. جدول نشان می داد که عناصر با خواص مشابه معمولا ظرفیت یکسانی نیز دارند. بطور همزمان ویلیام ادلینگ (William Odling) طبقه بندی از 57 عنصر ارائه داد که براساس جرمهای اتمیشان مرتب شده بودند. باوجود برخی بی نظمی ها و جاهای خالی، او متوجه یک تناوب در جرمهای اتمی شد که موافق با عناصری که معمولا بعلت خواص مشابه در یک گروه قرار داده می شدند، بود. ادلینگ به قانون تناوبی اشاره کرد، اما آن را پیگیری نکرد. در سالهای 1863 تا 1866، جان نیولندز (John Newlands) مقالاتی ارائه داد و اشاره کرد که هنگامیکه عناصر بر اساس افزایش جرمهای اتمیشان مرتب می شوند، خواص شیمیائی و فیزیکی یکسان در فاصله های هشتایی تکرار می شود و آن را به تناوب اکتاوها در موزیک ارتباط داد و از این رو مورد استقبال قرار نگرفت. بهر حال نیولندز جدولی از عناصر ارائه داد و از آن برای حدس زدن وجود عناصر گم شده ای مثل ژرمانیم استفاده کرد. در سال 1867، گوستاووس هنریش (Gustavus Hinrichs) یک سیستم تناوبی مارپیچی بر اساس طیف ها و جرمهای اتمی و تشابه خواص ارائه داد، اما کار او هم مورد استقبال قرار نگرفت.
دیمیتری مندلیف (Dmitri Mendeleev) در سال 1869 و میر در سال 1870 ( که توسعه یافته کار ارائه شده اش در سال 1864 بود) بطور جداگانه جداول تناوبی خود را ارائه دادند که هر دو عناصر را در سطرها یا ستون ها به ترتیب جرمهای اتمیشان لیست کرده بودند و هنگامیکه خواص عناصر تکرار می شد، یک سطر یا ستون جدید آغاز می شد. مورد قبول واقع شدن و مشهور شدن جدول تناوبی مندلیف از آنجا ناشی شد که او در جدول خود جاهای خالی برای عناصری که براساس شباهت در خواص به نظر کشف نشده بودند، در نظر گرفت. البته او اولین کسی نبود که اینکار را انجام می داد، اما بعنوان اولین کسی شناخته شد که بر اساس خواص تناوبی در جدول خود، خواص آن عناصر کشف نشده مثل گالیم و ژرمانیم را حدس زد. همچنین او در برخی موارد ترتیب جرمهای اتمی را در نظر نمی گرفت و برخی عناصر مجاور هم مثل تلوریم و ید را برخلاف ترتیب جرمهای اتمیشان جابجا می کرد تا گروه بندی بهتری بر اساس خواص شیمیائی ارائه دهد. در سال 1871، مندلیف فرم دیگری از جدول خود را ارائه داد که در آن گروهها با عناصر مشابه در هشت ستون از I تا VIII قرار گرفته بودند. با توسعه تئوری های اتمی معلوم شد که مندلیف ناخودآگاه عناصر را در جدول خود بر اساس اعداد اتمی یا بار هسته شان مرتب کرده است و مرتب سازی عناصر بر حسب افزایش عدد اتمی با درنظرگرفتن آرایش الکترونی ها روش مناسبی برای طبقه بندی آنهاست.
با کشف عناصر بیشتر و توسعه تئوریها جدول تناوبی پیشنهاد شده توسط مندلیف به مرور عوض شد. طرح جدول تناوبی استاندارد یا معمول کنونی به جدول ارائه شده توسط دمینگ (Horace Groves Deming) در سال 1923 برمیگردد که بطور گسترده منتشر شد. البته در جدول دمینگ آکتینیدها به اشتباه بعنوان سطر چهارم بلوک d محسوب می شدند که در سال 1945، سیبرگ (Glenn Seaborg) پیشنهاد کرد که آکتینیدها مانند لانتانیدها در حال پرکردن زیرلایه f هستند و معلوم شد که حق با اوست.

Dmitri Ivanovich Mendeleev (8 February 1834 – 2 February 1907)
فرم استاندارد یا معمول جدول تناوبی های امروزی بصورت شبکه ای از عناصر است که در هفت سطر و هیجده ستون بعلاوه دو سطر در زیر آنها قرار گرفته اند. در جدول تناوبی سطرها معمولا دوره یا تناوب و ستونها گروه نامیده می شوند. دوره ها با شماره دوره از یک تا هفت و گروهها با شماره گروه از یک تا هیجده مشخص می شوند. در هر دوره از جدول تناوبی زیرلایه های (n-2)f, ns ، (n-1)d ، np ( در صورت وجود) بترتیب پر می شوند. بعبارتی زیرلایه هایی که در هر دوره از جدول تناوبی پر می شوند بهمراه ترتیب پر شدن آنها بصورت زیر است:
با توجه به ظرفیت زیر لایه ها محل پرشدن زیر لایه های d,p,s و f بترتیب شامل 10,6,2 و 14 عنصر خواهد بود. از آنجائیکه محل پرشدن زیرلایه f شامل 14 عنصر خواهد بود و نمایش آن در محل واقعی منجر به بسیار طویل شدن جدول تناوبی و ایجاد مشکل در نمایش آن می شود، محل پرشدن زیرلایه f در پایین دیگر زیرلایه ها بصورت مستقل نمایش داده می شود. شکل بعدی این مطالب را نشان می دهد.

همانطور که گفتیم، فرم استاندارد یا معمول جدول تناوبی های امروزی بصورت شبکه ای از عناصر است که در هفت سطر و هیجده ستون بعلاوه دو سطر در زیر آنها قرار گرفته اند. شکل بعدی این مطلب را نمایش می دهد.

جدول تناوبی به چهار بلوک d,p,s و f می تواند تقسیم شود که در هر بلوک، زیرلایه مربوطه در حال پر شدن است. شکل بعدی را در نظربگیرید.

در جدول تناوبی، به عناصری که اوربیتالهای s و p آنها در حال پرشدن است ( یا در واقع در بلوک s یا p قرار دارند) عناصر گروه اصلی (Main Group Elements) یا بطور ساده تر عناصر اصلی، به عناصری که اوربیتالهای dآنها در حال پرشدن است ( یا در واقع در بلوک d قرار دارند) فلزات واسطه خارجی یا بطور ساده تر فلزات واسطه (Transition Metals) و به عناصری که اوربیتالهای f آنها در حال پرشدن است ( یا در واقع در بلوک f قرار دارند) فلزات واسطه داخلی (Inner Transition Metals) گفته می شود. به فلزات واسطه داخلی که اوربیتالهای 4f آنها در حال پر شدن است، لانتانیدها و به فلزات واسطه داخلی که اوربیتالهای 5f آنها در حال پر شدن است، آکتینیدها می گویند. شکل بعدی را در نظر بگیرید.

همانطور که گفتیم، گروهها با شماره گروه از یک تا هیجده مشخص می شوند. در قدیم که امروزه نیز استفاده می شود، گروههای عناصر اصلی با IA تا VIIIA ( معادل 1، 2 و 13 تا 18) و گروههای عناصر واسطه با IB تا VIIIB (معادل 3 تا 12) مشخص می شدند. شماره گذاری گروههای عناصر واسطه بر اساس شباهت آنها با گروههای عناصر اصلی از لحاظ ظرفیت بوده است.
همچنین هر گروه معمولا به نام عنصر بالایی یا همان سردسته گروه که عنصر گروه با کمترین عدد اتمی است، خوانده می شود. مثلا گروه آهن را می توان در نظر گرفت که شامل آهن، روتنیم، اسمیم و هاسیم است. برخی گروهها نیز نامهای مخصوص خودشان را دارند که در جدول زیر بهمراه علت نامگذاری ذکر شده است.
|
شماره گروه |
نام اختصاصی |
دلیل نامگذاری |
|
گروه 1 یا IA |
گروه فلزات قلیایی ( Alkali Metals) |
بوجود آوردن قلیا (باز) موقع واکنش فلزات گروه با آب |
|
گروه 2 یا IIA |
گروه فلزات قلیایی خاکی ( Alkaline Earth Metals) |
بوجود آوردن قلیا (باز) موقع واکنش اکسید فلزات گروه با آب که اکسید فلزات گروه زمانی در طبقه بندی خاکیها یا زمینی ها ( ترکیبات غیرفلز نامحلول در آب و مقاوم در برابر حرارت) قرار می گرفتند. |
|
گروه 5 یا VA |
گروه نیکتوژنها ( Pnictogens) |
ویژگی سرفه آورندگی یا خفه کنندگی نیتروژن در غیاب اکسیژن |
|
گروه 6 یا VIA |
گروه کالکوژنها ( Chalcogens) |
حضور در ترکیبات اغلب سنگ های معدنی |
|
گروه 7 یا VIIA |
گروه هالوژنها ( Halogens) |
بوجود آوردن نمکها مثل نمک دریا |
|
گروه 8 یا VIIIA |
گروه گازهای نجیب یا بی اثر ( Noble or Inert Gases) |
عدم واکنش پذیری یا واکنش پذیری خیلی کم |
عناصر واقع در گروههای یکسان معمولا در آرایش الکترونی بعد از گاز نجیب ماقبل خود مشابهند. بعنوان مثال آرایش الکترونی برای عناصر گروه تیتانیم یعنی 72Hf,40Zr,22Ti و 104Rf به ترتیب بصورت [Xe]6s24f145d2,[Kr]5s24d2,[Ar]4s23d2 و [Rn]7s25f146d2 است که همگی به (n-1)d2ns2 ( بعلاوه (n-2)f14 در صورت وجود) ختم می شوند. البته گاهی اوقات نیز آرایش الکترونی عناصر همگروه بطور جزئی با هم متفاوت است. بعنوان مثال آرایش الکترونی برای عناصر گروه نیکل یعنی 46Pd,28Ni و 78Pt به ترتیب بصورت [Kr] 4d10,[Ar]4s23d8 و [Xe]6s15f145d9 است. عناصر واقع در گروههای اصلی یکسان حتما در آرایش الکترونی لایه اصلی آخر که لایه والانس نیز نامیده می شود، یکسانند. جدول بعدی این مطلب را نشان می دهد.
|
آرایش الكترونی لایه آخر |
گروه |
|
(فلزات قلیایی)IA (1) |
|
|
(فلزات قلیایی خاكی)IIA (2) |
|
|
(گروه بور)IIIA (13) |
|
|
|
(گروه كربن)IVA (14) |
|
|
(گروه نیتروژن)VA (15) |
|
|
(گروه اكسیژن)VIA (16) |
|
|
(گروه هالوژن ها)VIIA (17) |
|
|
(گروه گازهای نجیب)VIIIA (18) |
عناصر واقع در گروههای یکسان معمولا خواص شیمیایی کمابیش یکسانی نشان می دهند، البته با افزایش فاصله آنها در یک گروه ممکن است تغییرات قابل توجهی از بابت خواص وجود داشته باشد. گاهی اوقات عناصر واقع در دوره های یکسان نیز خواص مشابهی دارند، مثلا لانتانیدها در دوره ششم و آکتینیدها در دوره هفتم یا به مقدار کمتر فلزات واسطه خارجی همدوره را می توان در نظر گرفت. همچنین ممکن است برای برخی عناصر که در یک یا چند ویژگی بخصوص مشترکند، دسته بندی های مخصوصی در نظر گرفته شود. بعنوان مثال می توان فلزات گرانبها (Precious Metals) را در نظر گرفت که در طبیعت کمیابند ، گرانبها هستند و شامل طلا، نقره، پلاتین، پالادیم، روتنیم، رودیم، اسمیم و ایریدیم می شوند.
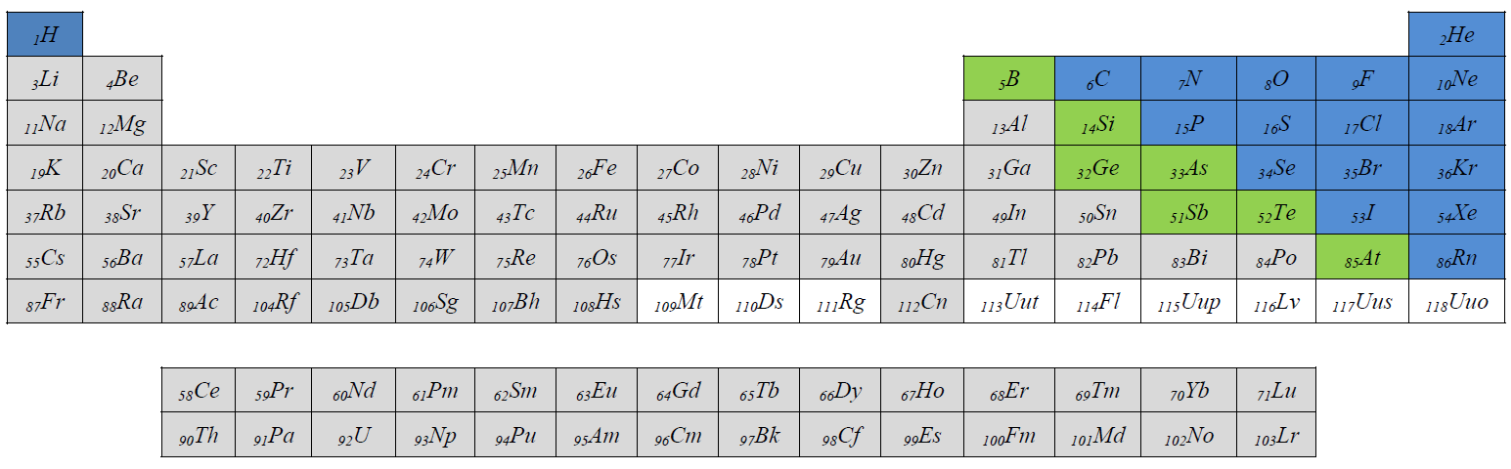
عناصر را می توان به فلزات (Metals)، نافلزات (Nonmetals) و شبه فلزات (Metalloids) طبقه بندی کرد. بطور معمول اتمهای فلزات براحتی الکترون از دست می دهند و کاتیون بوجود می آورند، در حالیکه اتمهای نافلزات براحتی الکترون می گیرند و آنیون بوجود می آورند. شبه فلزات هم از نظر خواص مابین فلزات و نافلزات هستند. بعدها با خواص فلزات، نافلزات و شبه فلزات بیشتر و دقیقتر آشنا خواهیم شد. در حدود 91 عنصر از 118 عنصر جدول تناوبی فلز هستند. شکل بعدی موقعیت فلزات، نافلزات و شبه فلزات را در جدول تناوبی نشان می دهد که فلزات با رنگ طوسی، نافلزات با رنگ آبی و شبه فلزات با رنگ سبز نمایش داده شده اند. در جدول بعدی عناصری که خواص شیمیائیشان بطور دقیق معلوم نیست، بدون رنگ هستند.
خوب است که عناصر گروه های اصلی را بصورت گروه به گروه بعلاوه سطر اول عناصر واسطه بخاطر بسپاریم. این امر در حل سوالهای مربوط به جدول تناوبی می تواند مفید واقع شود. بخاطر سپردن گازهای نجیب به همراه اعداد اتمیشان نیز می تواند در بدست آوردن آرایش الکترونی عناصر مفید باشد. مثالهای بعدی را در نظر بگیرید.
مثال: آرایش الکترونی سرب (82Pb) را در حالت پایه بنویسید.
حل:
عدد اتمی سرب بین اعداد اتمی گازهای نجیب زنون (54Xe) و رادون (86Rn) است. بنابراین آرایش الکترونی سرب به صورت ترکیب آرایش الکترونی زنون با 54 الکترون و آرایش الکترونی 82-54=28 الکترون باقیمانده خواهد بود. از آنجائیکه زنون گاز نجیب دوره پنجم است، 28 الکترون باقیمانده در زیرلایه های مربوط به تناوب بعدی یعنی تناوب ششم که عبارتنداز 5d,4f,6s و 6p به ترتیب قرار خواهند گرفت و در نهایت آرایش الکترونی سرب به صورت زیر خواهد بود:
82Pb:[54Xe]4f145d106s26p2
*****
مثال: در آرایش الکترونی ایندیم (49In) در حالت پایه چند اوربیتال با ml=-2 بصورت پر شده هستند؟
حل:
هر زیرلایه d یا f پر شده یک اوربیتال با ml=-2 بصورت پر شده دارد. بنابراین برای تعیین تعداد اوربیتالها با ml=-2 بصورت پر شده در ایندیم بایستی تعداد زیرلایه های d یا f پر شده آن را بدست آوریم. ایندیم در گروه بور که شامل بور، آلومینیوم، گالیم، ایندیم و تالیم است، قرار دارد. بنابراین ایندیم در سه تناوب بعد از بور قرار دارد و از آنجائیکه بور در تناب دوم است، ایندیم در تناوب پنجم خواهد بود. در تناوب های اول، دوم و سوم پر شدن زیرلایه d یا f را نداریم. در تناوب چهارم زیرلایه 3d پر می شود و در تناوب پنجم قبل از ایندیم زیرلایه 4d پر می شود. پس در آرایش الکترونی ایندیم در حالت پایه دو زیرلایه d پر و دو اوربیتال با ml=-2 بصورت پر شده خواهیم داشت.
*****
مثال: فرض کنید عدد کوانتومی مغناطیسی اسپینی (ms) بجای دو مقدار می توانست سه مقدار داشته باشد. در اینصورت آرایش الکترونی گاز نجیب دوره دوم متعلق به جدول تناوبی جدید به چه صورت می شد؟
حل:
اگر ms می توانست سه مقدار داشته باشد، ظرفیت هر اوربیتال بجای دو الکترون برابر سه الکترون می شد. در اینصورت آرایش الکترونی گاز نجیب دوره دوم که در آن اوربیتال ها و زیر لایه های مربوط به تناوب اول و دوم یعنی 2s,1s و 2p کاملا پر هستند، به صورت زیر می شد:
1s32s32p9
*****
علاوه بر فرم استاندارد جدول تناوبی، طرحهای بسیار دیگری نیز برای آن وجود دارند. بعد از ارائه جدول تناوبی مندلیف در حدود 700 طرح گوناگون برای جدول تناوبی منتشر شده است. بعنوان مثال می توان طرح تئودور بنفی (Theodor Benfey) مربوط به سال 1960 را که بصورت مارپیچ است و در شکل بعدی نمایش داده شده است، در نظر گرفت.

جدول تناوبی تئودور بنفی (Theodor Benfey)
گاهی اوقات موقع نمایش جدول تناوبی ممکن است اطلاعاتی از قبیل حالت ( گاز، مایع یا جامد بودن) عنصر در دما و فشار اتاق، دمای ذوب و جوش، شعاع اتمی و ... نیز با استفاده از رنگ، عدد، شکل یا نوشته بر روی جدول تناوبی نمایش داده شوند. بعنوان مثال اشکال بعدی را در نظر بگیرید.


