رزونانس
گاهی اوقات الکترونها چه پیوندی و چه غیرپیوندی، ویژگی غیرمستقر بودن از خود نشان می دهند. الکترونهای پیوندی ممکن است به جای اینکه بین دو اتم مستقر باشند، بین بیش از دو اتم قرار بگیرند که به چنین الکترون هایی که بین بیش از 2 اتم به اشتراک گذاشته می شوند و جاذبه بیش از 2 هسته را احساس می کنند، الکترون های پیوندی غیرمستقر می گوئیم. الکترونهای غیرپیوندی نیز ممکن است به جای اینکه بر روی یک اتم مستقر باشند، بر رو یا بین دو یا چند اتم بصورت همزمان قرار گیرند و حالت غیرمستقر پیدا کنند. ساختارهای لوییس درنمایش الکترون های غیرمستقر ضعف دارند و برای نمایش آنها متوسل به پدیده رزونانس می شوند. در رزونانس مکانهای مختلف امکانپذیر الکترون های غیرمستقر به صورت ترکیبی از شکل های رزونانسی نمایش داده می شوند. هر شکل رزونانسی الکترون های غیرمستقر را در یکی از حالت های امکانپذیر به صورت مستقر نمایش می دهد. رزونانس را با فلش دو طرفه بین شکلهای رزونانسی نمایش می دهیم و ساختار مولکول واقعی را از هیبرید رزونانسی یا ترکیب رزونانسی شکل های رزونانسی به دست می آوریم. به عبارتی ساختار مولکول واقعی از میانگین گیری شکل های رزونانسی به دست می آید.
بعنوان
مثال می توان
رزونانس در
مولکول ![]() را
در نظر گرفت.
در این مولکول
دو الکترون
پیوندی پای
داریم که در
نواحی
همپوشانی یکی
از اوربیتال
های 3p گوگرد با
دو اوربیتال 2p
اتمهای
اکسیژن قرار
می گیرند و بنابراین
بر روی هر سه
اتم قرار
دارند و غیرمستقر
محسوب می
شوند. مولکول
را
در نظر گرفت.
در این مولکول
دو الکترون
پیوندی پای
داریم که در
نواحی
همپوشانی یکی
از اوربیتال
های 3p گوگرد با
دو اوربیتال 2p
اتمهای
اکسیژن قرار
می گیرند و بنابراین
بر روی هر سه
اتم قرار
دارند و غیرمستقر
محسوب می
شوند. مولکول ![]() دو
شکل رزونانسی
دارد (ساختارهای
(1) و (2)) که هر شکل
رزونانسی یکی
از موقعیت های
امکان پذیر
برای جفت
الکترون
پیوندی پای را
نمایش می دهد:
دو
شکل رزونانسی
دارد (ساختارهای
(1) و (2)) که هر شکل
رزونانسی یکی
از موقعیت های
امکان پذیر
برای جفت
الکترون
پیوندی پای را
نمایش می دهد:
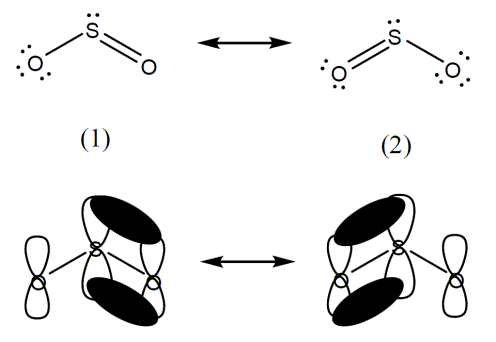
خواص
مولکول واقعی ![]() با
ترکیب خواص
شکلهای
رزونانسی اش
بدست می آید.
مثلا در
با
ترکیب خواص
شکلهای
رزونانسی اش
بدست می آید.
مثلا در ![]() نمایش
داده شده در ساختارهای
(1) و (2) یک پیوند
نمایش
داده شده در ساختارهای
(1) و (2) یک پیوند ![]() یگانه
(بلند و ضعیف) و
یک پیوند
یگانه
(بلند و ضعیف) و
یک پیوند ![]() دوگانه
(کوتاه و قوی)
داریم. در
واقعیت در
دوگانه
(کوتاه و قوی)
داریم. در
واقعیت در ![]() هر
دو پیوند
کاملاً هم ارز
هستند و از
لحاظ خواص
مابین یگانه و
دوگانه هستند
که این مطلب
با میانگین
گیری از ساختارهای
(1) و (2) بدست می
آید. بایستی
در نظر داشت
که در نظر
گرفتن ترکیب
ساختارهای 1
و 2 بعنوان
ساختار
مولکول واقعی SO2 به معنی
این نیست که
در ماده SO2 نیمی از
مولکولها
ساختار 1 و
نیمی دیگر
ساختار 2 را
دارند. همچنین
به این معنی
هم نیست که یک
مولکول SO2 لحظاتی
ساختار 1 و
لحظاتی
ساختار 2 را
دارد. بلکه
تمام
مولکولهای SO2 در تمام
لحظات یک شکل
دارند و آن
شکل نه ساختار
1 و نه ساختار 2
بلکه ساختاری
میانگین این
دو ساختار
است. ساختارهای
1 و 2 فرضی
هستند در
حالیکه
میانگین آنها
ساختاری واقعی
است. این
مطالب در مورد
مابقی
رزونانس ها
نیز بطور
مشابه برقرارند.
هر
دو پیوند
کاملاً هم ارز
هستند و از
لحاظ خواص
مابین یگانه و
دوگانه هستند
که این مطلب
با میانگین
گیری از ساختارهای
(1) و (2) بدست می
آید. بایستی
در نظر داشت
که در نظر
گرفتن ترکیب
ساختارهای 1
و 2 بعنوان
ساختار
مولکول واقعی SO2 به معنی
این نیست که
در ماده SO2 نیمی از
مولکولها
ساختار 1 و
نیمی دیگر
ساختار 2 را
دارند. همچنین
به این معنی
هم نیست که یک
مولکول SO2 لحظاتی
ساختار 1 و
لحظاتی
ساختار 2 را
دارد. بلکه
تمام
مولکولهای SO2 در تمام
لحظات یک شکل
دارند و آن
شکل نه ساختار
1 و نه ساختار 2
بلکه ساختاری
میانگین این
دو ساختار
است. ساختارهای
1 و 2 فرضی
هستند در
حالیکه
میانگین آنها
ساختاری واقعی
است. این
مطالب در مورد
مابقی
رزونانس ها
نیز بطور
مشابه برقرارند.
سهم هر
شکل رزونانسی
در تعیین خواص
مولکولی واقعی
تابعی از
پایداری آن
شکل رزونانسی
است. هر چه یک
شکل رزونانسی
پایدارتر
باشد، آن شکل
رزوناسی
مطلوبتر
خواهد بود و سهم
آن در تعیین
خواص مولکول
واقعی بیشتر خواهد
بود یا ساختار
مولکول واقعی مربوطه
به آن شکل
رزونانسی
نزدیکتر
خواهد بود. در
صورتیکه
شکلهای
رزونانسی
مشابه باشند
سهم آنها نیز
یکسان خواهد
بود و میانگین
گیری دقیقاً
خواص مولکول
واقعی را
تعیین میکند. مثلا
برای ![]() که شکلهای
رزونانسی
مشابه هستند، سهم
هر شکل
رزونانسی
برابر %50 است.
که شکلهای
رزونانسی
مشابه هستند، سهم
هر شکل
رزونانسی
برابر %50 است.
الکترونهای غیرمستقر جاذبه تعداد هسته های بیشتری را احساس میکنند، به همین جهت از الکترونهای مستقر پایدارترند. وجود الکترونهای غیرمستقر یا وجود رزونانس باعث افزایش انرژی پیوندها و پایداری ترکیب میشود که از پایداری حاصله به عنوان پایداری رزونانسی یاد می شود. هر چه تعداد شکل های رزونانسی بیشتر باشد و پایداری شکل های رزونانسی به همدیگر نزدیک تر باشد، پایداری حاصل از رزونانس بیشتر خواهد بود.
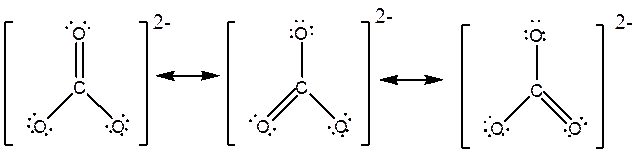
مثال: تمام شکلهای رزونانسی ترکیبات زیر را رسم کنید و سهم هر شکل رزونانسی و مرتبه پیوندها را تعیین کنید.
![]()
حل:
سهم هر شکل: 33.3% مرتبه پیوند CO : 1.33
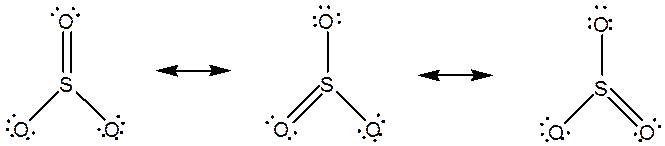
سهم هر شکل: 33.3% مرتبه پیوند SO : 1.33
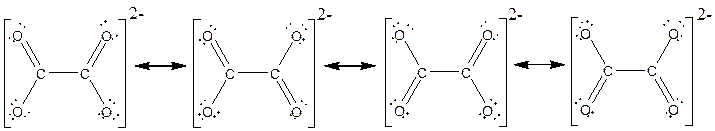
سهم هر شکل: 25% مرتبه پیوند CO : 1.5 مرتبه پیوند CC : 1
*****
مثال: شکل های رزونانسی بنزن (C6H6) حاوی یک حلقه شش ضلعی از اتمهای کربن که به هر اتم کربن یک هیدروژن متصل است، را رسم نمایید.
حل:
بر مبنای اطلاعات مسئله دو شکل رزونانسی زیر را می توان در نظر گرفت که به افتخار کاشف آنها ساختارهای ککوله بنزن نامیده می شوند:

بنزن یک مولکول مسطح است (در یک صفحه جای می گیرد) و شش اوربیتال p شش اتم کربن که عمود بر صفحه شش ضلعی هستند، بطور همزمان بصورت جانبی با هم همپوشانی می کنند و شش الکترون پای را در خود جای می دهند و دو حلقه الکترونی در بالا و پایین شش ضلعی اتمهای کربن بوجود می آورند. برای سادگی ممکن است ساختارهای بالا را به صورت زیر نیز نشان دهند که اتمهای هیدروژن نمایش داده نشده اند و اتمهای کربن در راس های شش ضلعی در نظر گرفته می شوند:
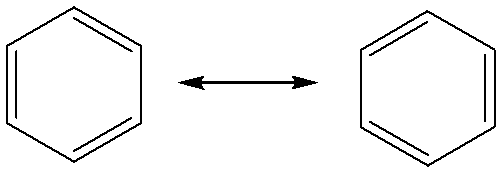
همچنین نمایش خلاصه زیر نیز برای بنزن وجود دارد که حلقه های الکترونی بنزن یا همان الکترونهای پای را به صورت یک دایره داخل بنزن در نظر می گیرد:
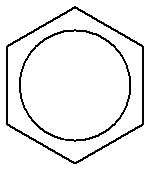
در صورت جایگزینی یک یا چند اتم هیدروژن بنزن با اتم دیگر یا گروهی از اتمهای دیگر بایستی نماد اتم یا گروه مربوطه نوشته شده و محل اتصال آنها مشخص شود. مثلا ترکیب حاصل از جایگزینی دو اتم هیدروژن بنزن بر روی دو اتم کربن مجاور با دو اتم فلوئور می تواند به صورت زیر نمایش داده شود:

*****
تمرین: تمام شکلهای رزونانسی ترکیبات زیر را رسم کنید و سهم هر شکل رزونانسی و مرتبه پیوندها را تعیین کنید.
![]()
*****
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||