آنتروپي
آنتروپي
يك سيستم
معياري از بي
نظمي آن سيستم
است. بعبارتی
هر چه سيستم
بي نظم تر
باشد،
آنتروپي آن
بيشتر است و
بالعكس و فرآيند
هايي كه بي
نظمي را
افزايش مي
دهند، در واقع
آنتروپي را
افزايش مي
دهند. آنتروپي
را با ![]() و
تغييرات آن را
با
و
تغييرات آن را
با ![]() نمايش
مي دهيم. واحد
آن، انرژي بخش
بر دماي مطلق
مثل
نمايش
مي دهيم. واحد
آن، انرژي بخش
بر دماي مطلق
مثل ![]() يا
يا![]() است.
آنتروپي يك
تابع حالت و
يك كميت
مقداري است و
آنتروپي مولي
(آنتروپي
بازاي يك مول)
نيز با واحد
هايي مثل
است.
آنتروپي يك
تابع حالت و
يك كميت
مقداري است و
آنتروپي مولي
(آنتروپي
بازاي يك مول)
نيز با واحد
هايي مثل ![]() يا
يا
![]() تعريف
و استفاده میشود.
تعريف
و استفاده میشود.
افزايش بي نظمي يا آنتروپی سيستم معادل با كاهش اطلاعات ما در مورد سيستم است و از لحاظ آماري به معناي افزایش تعداد حالتهاي امكان پذير براي سيستم است. براي درك بهتر موضوع يك اتاق حاوي اشيائي مثل قفسه كتابخانه، تعدادي كتاب، ميز، تخت خواب و.... در نظر بگيريد. در صورتيكه اتاق منظم باشد، جاي هر شيء از قبل معلوم است. بعنوان مثال انتظار داريم در يك اتاق منظم يك كتاب بخصوص را در قفسه هاي كتابخانه و نه جاهاي ديگر اتاق بيابيم. در حاليكه اگر اتاق نامنظم باشد، اطلاعات ما در مورد جاي هر شيء ناقص خواهد بود و حالتهاي مختلفي براي جاي هر شي ء در اتاق وجود خواهد داشت. بعنوان مثال يك كتاب بخصوص ممكن است در قفسه كتابخانه يا روي ميز يا زير تخت خواب يا .... باشد. بطور كاملاً مشابه در برخي فرآيندها كه به اصطلاح همراه با افزايش آنتروپی يا بي نظمي هستند، اطلاعات ما در مورد سيستم، ذرات و خصوصيات ذرات آن كاهش مي یابد و حالتهاي امكان پذير افزايش مي يابد، در حاليكه در برخي ديگر از فرآيندها كه همراه با کاهش آنتروپي يا بي نظمي هستند، برعكس آن رخ مي دهد. بعنوان مثال فرض كنيد دو بالون شيشه اي هم اندازه كه آنها را بالون هاي 1 و 2 مي ناميم، داريم كه توسط يك لوله شيشه اي نازك بهم مرتبط هستند. در ابتدا در بالون 1 مقداري گاز و در بالون 2 خلاء داريم و ارتباط دو بالون توسط شير موجود بر روي لوله رابط بالون ها قطع شده است ( شير بسته است). با باز كردن شير، گاز درون بالون 1 منبسط میشود و حجم هر دو بالون را پر مي كند. قبل از باز كردن شير مي دانيم كه هر ذره گاز در فضاي درون بالون 1 قرار دارد، در حاليكه بعد از بازكردن شير بايد در يك فضاي بزرگتر يعني حجم هر دو بالون به دنبال ذره هاي گاز باشيم. بعبارتی با انبساط گاز اطلاعات ما در مورد موقعيت ذرات نادقيق تر و كمتر مي شود. از يك نگاه ديگر قبل از باز كردن شير براي موقعيت هر ذره گاز فقط يك حالت داريم: درون بالون 1، در حاليكه بعد از باز كردن شير، براي موقعيت هر ذره گاز دو حالت داريم و ممكن است ذره گاز در بالون 1 يا در بالون 2 باشد. بنابراين در اينجا با بازكردن شير و انبساط گاز تعداد حالتهاي امكان پذير براي سيستم افزايش مي یابد. پس انبساط گازها مي تواند جز فرآيندها همراه با افزايش آنتروپي در نظر گرفته شود.
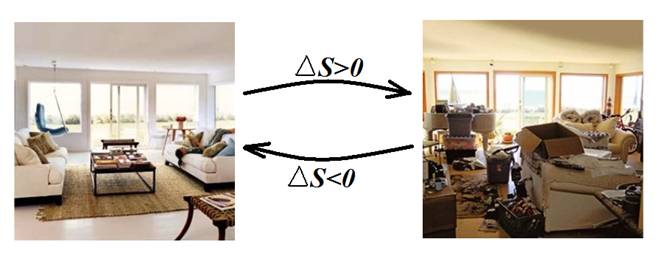
بطور كلي فرآيندهايي مثل افزايش حجم(انبساط)، افزايش دما، انحلال و اختلاط به جز حل شدن گازها در مايعات و جامدات و برخي موارد خاص، ذوب ، تبخير ، تصعيد و ... همراه با افزايش آنتروپي هستند (∆S>0 )، در حاليكه بر عكس آنها همراه با كاهش آنتروپي (∆S<0) است.
به هر ماده مي توان آنتروپي مولي نسبت داد كه مقدار آن به جنس ماده، حالت و دماي آن بستگي خواهد داشت. براي هر ماده با تغييرحالت از جامد به مايع و از مايع به گاز آنتروپي افزايش مي یابد و براي هر حالت مشخص با افزايش دما نيز آنتروپي افزایش مي يابد، شكل بعدي را در نظر بگيريد:
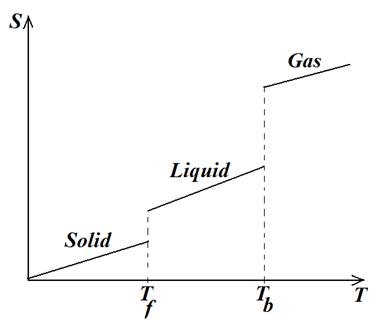
شکل: تغییرات آنتروپی یک ماده با تغییرات دما
واكنشها
نيز تغيير آنتروپي
مخصوص خود را
خواهند داشت
كه براي هر
واكنش، تغيير
آنتروپي
واكنش برابر
مجموع آنتروپی
محصولات آن
واكنش منهاي
مجموع
آنتروپي مواد
اوليه آن واكنش
خواهد بود. از
آنجائيكه
آنتروپي
گازها معمولاً
به مراتب از
آنتروپي
مايعات و
جامدات بيشتر
است، مقدار
تقريبي و علامت
تغيير
آنتروپي يك
واكنش
معمولاً بر
اساس مواد
گازي شكل
موجود در آن
واكنش تعيين
میشود. اگر
يك واكنش
همراه با
توليد گاز
باشد يا به عبارتی
![]() يا
تغيير تعداد
مول مواد گازي
شكل براي آن (مجموع
مول مواد گازی
شکل در سمت
محصولات منهای
مجموع مول
مواد گازی شکل
در سمت مواد
اولیه) مثبت
باشد، تغییر
آنتروپي آن
واكنش
معمولاً مثبت
خواهد بود، در
حاليكه اگر يك
واكنش همراه
با مصرف گاز
باشد، يا به عبارتی
يا
تغيير تعداد
مول مواد گازي
شكل براي آن (مجموع
مول مواد گازی
شکل در سمت
محصولات منهای
مجموع مول
مواد گازی شکل
در سمت مواد
اولیه) مثبت
باشد، تغییر
آنتروپي آن
واكنش
معمولاً مثبت
خواهد بود، در
حاليكه اگر يك
واكنش همراه
با مصرف گاز
باشد، يا به عبارتی
![]() يا
تغيير تعداد
مول مواد گازي
شكل براي آن
منفي باشد،
تغيير
آنتروپي آن
واكنش
معمولاً مثبت خواهد
بود. براي
واكنشي كه
تعداد مول
مواد گازي شكل
تغيير نمي كند
يا در آن
اصلاً گازها
حضور ندارند، اگر
چه در مورد
علامت
يا
تغيير تعداد
مول مواد گازي
شكل براي آن
منفي باشد،
تغيير
آنتروپي آن
واكنش
معمولاً مثبت خواهد
بود. براي
واكنشي كه
تعداد مول
مواد گازي شكل
تغيير نمي كند
يا در آن
اصلاً گازها
حضور ندارند، اگر
چه در مورد
علامت ![]() نمي
توان چيزي
گفت، اما
مقدار آن
معمولاً كم و
نزديك به صفر
است.
نمي
توان چيزي
گفت، اما
مقدار آن
معمولاً كم و
نزديك به صفر
است.
||||||||||||||||||||||||||||||||||||||||||||||||||
**************************************************
سایت: www.youngchemist.com
مولف: محمد شاهی
نظرات، پیشنهادات و انتقادات: chemistry.shahi@gmail.com
**************************************************
||||||||||||||||||||||||||||||||||||||||||||||||||